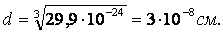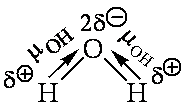Чем выше кратность связи тем меньше ее длина
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Чем выше кратность связи тем меньше ее длина
Ковалентная химическая связь имеет определенные качественные или количественные характеристики. К ним относятся:
4.1. Насыщаемость ковалентной связи
Атом не может образовать бесконечное число ковалентных связей, оно вполне определенное. Максимальное число связей, которое может образовать атом, определяется числом его валентных электронных орбиталей. Это и определяет насыщаемость ковалентной связи.
4.2. Энергия связи
Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Энергия связи отличается от ΔHобр. Теплота образования – это энергия, которая выделяется или поглощается при образовании молекул из простых веществ. Так:
Энергии связей в молекулах, состоящих из одинаковых атомов, уменьшаются по группам сверху вниз (табл. 4.1).
По периоду энергии связей растут. В этом же направлении возрастает и сродство к электрону
Энергии связей некоторых двухатомных молекул
Cs2
Если в молекуле соединяются более двух различных атомов, то средняя энергия связи не совпадает с величиной энергии диссоциации молекулы. Если в молекуле представлены различные типы связи, то каждому из них можно приближенно приписать определенное значение Е. Это позволяет оценить энергию образования молекулы из атомов. Например, энергию образования молекулы пентана из атомов углерода и водорода можно вычислить по уравнению:
В табл. 4.2 рассматривается взаимосвязь между энергией химической связи и свойствами веществ.
Взаимосвязь между энергией химической связи и свойствами веществ
Энергия связи, кДж/моль
Высокие твердость, прочность, температуры кипения и плавления
Высокая пластичность
Низкие твердость, прочность, температуры кипения и плавления
4.3. Длина связи
Длина связи – это расстояние между ядрами взаимодействующих атомов. Ориентировочно оценить длину связи можно, исходя из атомных или ионных радиусов, или из результатов определения размеров молекул с помощью числа Авогадро. Так, объем, приходящийся на одну молекулу воды: 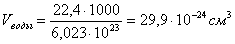
С помощью различных методов физико-химических исследований (например электронографии) определяют d более точно. Исследование длин связей показало, что для данной пары атомов в различных (сходных) соединениях длина связи остается величиной постоянной.
Из длин связей между атомами в молекуле можно вычислить ковалентные радиусы атомов. Если рассмотреть гомоядерные двухатомные молекулы с простой связью, такие как F 2 или С l 2, атомам F и С l можно приписать ковалентные радиусы простых связей, равные половине межъядерного расстояния в соответствующих молекулах. Для элементов, которые не могут образовать двухатомные молекулы с простыми связями, используют другие методы определения радиусов. Так, поскольку расстояние С—С в алмазе и множестве органических молекул найдено равным 1,54+0,01 Å, то ковалентный радиус атома углерода принимают равным 0,77. Чтобы получить ковалентный радиус атома азота, вычитают 0,77 из расстояния С—N в молекуле Н3С— NH 2, при этом получают 0,70. Этим способом можно составить таблицу ковалентных радиусов простых связей (табл. 4.3).
Некоторые ковалентные радиусы простых связей
Ковалентный радиус, Å
Ковалентный радиус, Å
Также можно получить и радиусы кратных связей. Например, для тройной связи радиусы атомов углерода и азота можно вычислить из длин связей в Н—С º С—Н и N º N ; они равны 0,60 и 0,55, причем для длины связи C º N они дают величину 1,15 по сравнению с 1,16, полученной экспериментально. Можно сделать вывод, что чем выше порядок связи между атомами, тем она короче (см. табл. 4.4).
4.4. Кратность связи
Кратность связи определяется количеством электронных пар, участвующих в связи между атомами. Химическая связь обусловлена перекрыванием электронных облаков. Если это перекрывание происходит вдоль линии, соединяющей ядра атомов, то такая связь называется σ-связью. Она может быть образована за счет s – s электронов, р – р электронов, s – р электронов. Химическая связь, осуществляемая одной электронной парой, называется одинарной.
Если связь образуется более чем одной парой электронов, то она называется кратной.
Кратная связь образуется в тех случаях, когда имеется слишком мало электронов и связывающихся атомов, чтобы каждая пригодная для образования связи валентная орбиталь центрального атома могла перекрыться с какой-либо орбиталью окружающего атома.
Поскольку р-орбитали строго ориентированы в пространстве, то они могут перекрываться только в том случае, если перпендикулярные межъядерной оси р-орбитали каждого атома будут параллельны друг другу. Это означает, что в молекулах с кратной связью отсутствует вращение вокруг связи.
4.5. Полярность связи
Если двухатомная молекула состоит из атомов одного элемента, как, например, молекулы Н2, N2, Cl 2 и т. п., то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распределяется в пространстве симметрично относительно ядер обоих атомов. В подобном случае ковалентная связь называется неполярной или гомеополярной. Если же двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает асимметрия в распределении заряда. В таких случаях ковалентная связь называется полярной или гетерополярной.
Для оценки способности атома данного элемента оттягивать к себе общую электронную пару пользуются величиной относительной электроотрицательности. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару. Иначе говоря, при образовании ковалентной связи между двумя атомами разных элементов общее электронное облако смещается к более электроотрицательному атому, и в тем большей степени, чем больше различаются электроотрицательности взаимодействующих атомов. Значения электроотрицательности атомов некоторых элементов по отношению к электроотрицательности фтора, которая принята равной 4, приведены в табл. 4.5.
У элементов одной и той же подгруппы электроотрицательность с ростом заряда ядра проявляет тенденцию к уменьшению. Таким образом, чем более типичным металлом является элемент, тем ниже его электроотрицательность; чем более типичным неметаллом является элемент, тем выше его электроотрицательность.
Относительная электроотрицательность элементов
Так, в молекуле хлористого водорода общая электронная пара смещена в сторону более электроотрицательного атома хлора, что приводит к появлению у атома хлора эффективного отрицательного заряда, равного 0,17 заряда электрона, а у атома водорода такого же по абсолютной величине эффективного положительного заряда. Следовательно, молекула НС1 является полярной молекулой. Ее можно рассматривать как систему из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга.
4.6. Типы ковалентных молекул
Электрический момент диполя молекулы представляет собой векторную сумму моментов всех связей и несвязывающих электронных пар в молекуле. Результат сложения зависит от структуры молекулы.
Многоатомные молекулы также могут быть неполярными при симметричном распределении зарядов, или полярными – при асимметричном распределении зарядов. В последнем случае дипольный момент молекулы будет отличаться от нуля. Каждой связи в многоатомной молекуле можно приписать определенный дипольный момент, характеризующий ее полярность; при этом следует принимать во внимание не только величину дипольного момента, но и его направление, т. е. рассматривать дипольный момент каждой связи как вектор. Тогда суммарный дипольный момент молекулы в целом можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному.
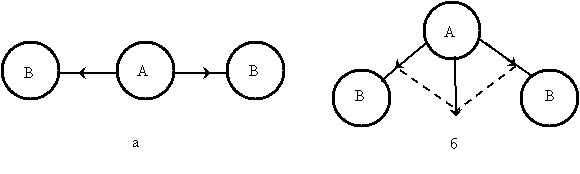
Рис. 4.1. Дипольные моменты отдельных связей в молекулах типа АВ2 различного строения: а – линейное строение, б – угловое строение
На рис. 4.1 изображены схемы возможного строения молекулы типа АВ2; векторы дипольных моментов отдельных связей А—В показаны стрелками, направленными от А к В. При линейном строении (рис. 4.1, а) равные по величине дипольные моменты двух связей А—В противоположны по направлению. Следовательно, дипольный момент такой молекулы будет равен нулю. В случае углового строения (рис. 4.1, б) векторная сумма дипольных моментов двух связей А—В отличается от нуля; такая молекула обладает дипольным моментом и является полярной. Поэтому наличие или отсутствие дипольного момента у молекулы типа АВ2 позволяет сделать вывод о ее геометрическом строении.
Например, молекула СО2 имеет симметричное линейное строение:
Полярность молекул оказывает заметное влияние на свойства образуемых ими веществ. Полярные молекулы стремятся ориентироваться по отношению друг к другу разноименно заряженными концами. Следствием такого диполь-дипольного взаимодействия является взаимное притяжение полярных молекул и упрочнение связей между ними. Поэтому вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества, молекулы которых неполярны.
Строение и ожидаемая полярность молекул
Пространственная конфигурация
Примеры
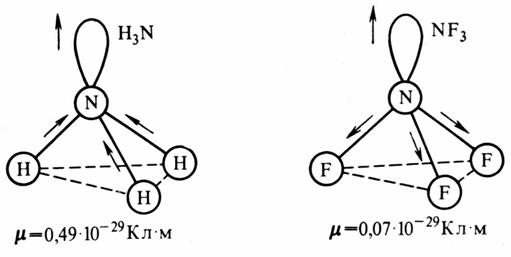
Рис. 4.2. Сложение электрических моментов диполя связывающей и несвязывающей электронных пар молекул H 3 N и NF 3
Это объясняется тем, что в Н3 N направление электрического момента диполя связывающей N—Н и несвязывающей электронной пары совпадает и при векторном сложении обусловливает большой электрический момент диполя. Наоборот, в NF 3 моменты связей N—F и электронной пары направлены в противоположные стороны, поэтому при сложении они частично компенсируются (рис. 4.2). Значения электрических моментов диполя некоторых молекул приведены в табл. 4.7.
Электрический момент диполя
4.7. Вопросы и задания
4.7.14. Вычислите среднюю энергию связи Н— Se и Н—Те для соединений H 2 Se и Н2Те, если стандартные теплоты образования этих соединений соответственно равны 85,77 и 154,39 кДж/моль. Энергия диссоциации H 2 равна 435,9 кДж/моль.
4.7.17. К каким атомам смещены связывающие электронные облака в следующих молекулах: а) НС1; б) НВг; в) HI ; г) NaH ; д) КН; е) ВеО; ж) N0; з) BN ; и) C 1 F ; к) ClBr ; л) MgS ; м) BeCl 2; н) ВВ r 3; о) СО2; п) OF 2; р) MgF 2; с) А1С13?
4.7.18. Рассчитайте эффективные заряды на атомах следующих молекул: a ) BrCl ; б) BrF ; в) C 1 F ; г) НС1; д) НВ r ; е) HI ; ж) LiBr ; з) LiF ; и) NaCl ; к) Nal ; л) NO ; м) Н2О ( NH 3 ( HNH = 107°).
4.7.19. Как изменяется полярность в ряду молекул: а) HF ; НС1; НВ r ; HI ; б) NH 3; РН3; А sH 3?
4.7.27. Какая молекула, аммиак или арсин имеет больший дипольный момент? Почему?
4.7.28. Почему молекула CCl 4 неполярная, а CH 3 Cl – полярная?