Что образуется в красном костном мозге
Не костный и не мозг
Спинномозговая пункция, 70 тысяч евро за донорство и другие фантазии о костном мозге
Первой в мире успешной трансплантации костного мозга на днях исполнится 50 лет, но в этой сфере по-прежнему живут удивительные заблуждения. Причем даже среди тех, кто связан с темой по долгу службы. Мы решили собрать главные ошибки и рассказать, как все устроено на самом деле.
Фантазия №1. Костный мозг – это мозг. Спинной или даже головной
«Донор костного мозга, это как? Череп вскрывают, что ли?» (из вопросов медицинскому директору Национального регистра доноров костного мозга имени Васи Перевощикова Ольге Макаренко перед донорской акцией в городе Каменске-Уральском, 15.09.2018, vk.com).
На самом деле. В костном мозге нет нервных клеток, костный мозг – вообще не мозг. Это главный кроветворный орган человека. Он находится внутри тазовых костей, ребер, грудины, костей черепа, в эпифизах (расширенных концах) длинных трубчатых костей и представляет собой мягкую, пронизанную сосудами массу ярко-красного цвета с большим количеством гемопоэтических стволовых клеток. Это «клетки-заготовки», которые пока не определились со своим будущим и могут превращаться в клетки разных типов. В костном мозге из стволовых клеток образуются клетки крови – лейкоциты, эритроциты и тромбоциты, которые затем попадают в кровеносную систему через капилляры. На костный мозг приходится примерно 5% веса человека.
Фантазия №2. Костный мозг достают большим шприцем из позвоночника или других костей
«Сара: Тете Косиме нужно кое-что. Это называется костный мозг. Его возьмут из твоего бедра. И им придется использовать большой шприц.
Кира: Я не люблю шприцы.
Сара: Я знаю. Но ты заснешь. И ничего не почувствуешь.
Кира: Тетя Косима умрет, если я этого не сделаю?
Сара: Ей очень нехорошо. Поэтому, скорее всего, да.
Кира: Ну тогда… я согласна»
(из сериала «Темное дитя», 2-й сезон, 9-я серия).
На самом деле. Для пересадки костного мозга нужен не костный мозг как таковой, а гемопоэтические (кроветворные) стволовые клетки. Их можно получать не только из костей, но и из крови, и чаще используется как раз второй способ. Донору дают специальные препараты, которые выгоняют гемопоэтические стволовые клетки из костного мозга в кровь. Процедура их забора устроена так: кровь берут из вены на одной руке, выделяют из нее гемопоэтические стволовые клетки и возвращают обратно через вену на другой руке. Процедура длится несколько часов, наркоз не требуется. А первый способ предполагает общую анестезию: из тазовых костей с помощью нескольких пункций берут до 5% костного мозга донора – это примерно литр смеси костного мозга и крови. Как правило, способ выбирает сам донор.
Фантазия №3. Донора костного мозга подбирают по группе крови
«Мне 42, группа крови 2+ Срочно буду донором костного мозга, недорого» (объявление на сайте deskmed.ru).
На самом деле. Совместимость костного мозга двух неродственников – большая редкость, в среднем – 1 на 10 тыс. Ткани донора и реципиента должны быть как можно более (в идеале – полностью) совместимы, иначе на чужеродный белок в организме может возникнуть иммунная реакция. Требования к совместимости тканей различны. В случае костного мозга сложность в том, что может возникнуть не только иммунная реакция реципиента на донорский костный мозг, но и обратная реакция – «трансплантат против хозяина». Пересаженный костный мозг может воспринять организм реципиента как чужеродный и начать с ним бороться. А вот группа крови у людей с тканевой совместимостью может быть разная.
Лучшие доноры костного мозга – родные братья и сестры. Для них вероятность совместимости – 25%. Во всех остальных случаях доноров подбирают по регистрам – гигантским базам данных о потенциальных донорах. Это люди, которые выразили готовность стать донорами костного мозга и прошли так называемое типирование – сдали кровь для определения своей тканевой совместимости.
Фантазия №4. Участник регистра обычно становится донором, иногда даже несколько раз
«Сегодня еще нет понятия «Почетный донор» для доноров костного мозга. Мы готовим объективное обоснование, что нужно принять такое решение и, конечно, повышать сумму компенсации подоходного налога» (глава ФМБА Владимир Уйба, из интервью «Известиям», 8 июня 2017 года).
На самом деле. Звание почетного донора ассоциируется с многократным донорством. Но даже однократное донорство костного мозга – удел немногих участников регистра. По статистике ВОЗ, ежегодно в мире проводится более 50 тыс. трансплантаций костного мозга, при этом в части операций используются доноры-родственники. Международный регистр насчитывает примерно 30 млн человек. Так что шанс участника регистра в течение года стать реальным донором – менее 1/600. В России донором стал каждый 300-й участник регистра. Бывают случаи, что подходящий реципиент наконец найден, но участник регистра вступил в него так давно, что уже забыл о своем решении и не готов к донорству.
Фантазия №5. На своем костном мозге можно неплохо заработать
На самом деле. Если речь не идет о родственной трансплантации, донора можно найти только через регистры. Ни один из существующих регистров не предусматривает вознаграждения донорам. Получение подходящего костного мозга в европейских базах, от поиска до доставки, обходится примерно в €18 тыс., в российской – примерно втрое дешевле. Но это медицинские и логистические расходы, донор не получает из этих денег ни копейки.
Корреспондент Русфонда позвонил по телефону, указанному в приведенном выше объявлении, и предложил продать свой костный мозг. Оператор спросил про группу крови (см. фантазию №3), сообщил, что она «очень хорошая» и вполне подходит, после чего предложил приехать на Сухаревскую площадь, 3 (это адрес НИИ имени Склифосовского) для сдачи анализов с последующим донорством костного мозга и получением денег. После вопроса о вероятности гистосовместимости оператор вежливо сообщил, что не будет продолжать разговор. Обычно с «донора» просто пытаются получить деньги за предварительные анализы, и на этом история заканчивается.
Фантазия №6. В России нет регистра костного мозга, потому что еще не приняли закон о нем
«Сейчас учет доноров и реципиентов осуществляется пятью медицинскими организациями с разными подходами. Есть все основания Минздраву России проанализировать сведения, включенные в данные регистры, и создать единую базу. Но хочу подчеркнуть, что создание такой базы невозможно без внесения изменений в действующую статью 147 ФЗ» (Татьяна Голикова, вице-премьер, на заседании Совета при правительстве РФ по вопросам попечительства в социальной сфере, 14 сентября 2018 года).
На самом деле. Отдельные регистры костного мозга создаются в России с конца 1970-х годов. Сейчас существует полтора десятка таких региональных регистров. В 2013 году Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова и Русфонд заключили договор о сотрудничестве для создания единого регистра доноров костного мозга. Он был создан в подведомственном университету НИИ детской онкологии, гематологии и трансплантологии имени Р.М. Горбачевой. Было разработано программное обеспечение для объединения баз данных. В следующие несколько лет в базу вошли уже существовавшие в России регистры. Сейчас в ней больше 85 тыс. потенциальных доноров. В 2015 году регистр был назван именем Васи Перевощикова – мальчика, которому так и не успели найти донора. Сейчас Русфонд работает над регистром без участия НИИ Горбачевой. В 2017 году Минюст зарегистрировал Национальный регистр доноров костного мозга имени Васи Перевощикова (БФ «РДКМ», регистрационный номер 1177700013853).
В начале сентября в Казани заработала новая NGS-лаборатория, специализирующаяся на первичном типировании добровольцев. Ее мощность – 25 тыс. доноров в год (для сравнения: в 2017 году страна протипировала всего 15 тыс. добровольцев). На типирование одного потенциального донора российские регистры тратят сейчас минимум 14 тыс. руб., Русфонд снизил стоимость реагентов в казанской лаборатории до 7 тыс. руб. Активацию донора из Национального регистра (подтверждение совместимости, полное обследование, подготовку к донации, командировку, страховку и забор костного мозга) будет оплачивать Русфонд.
Население России генетически очень разнообразно, у нас очень много малых народов (например, на Северном Кавказе), много смешанных браков. Для многих жителей России найти донора в международном регистре просто невозможно, потому стране так необходим Нацрегистр.
Фантазия №7. В России с трансплантацией костного мозга все неплохо
«Мы сделали существенный скачок в объемах и в качествах пересадки костного мозга. Только у детей мы сделали за прошлый год 500, а всего 1,5 тыс. операций. Если считать расчетно, сколько нам всего нужно, – нам нужно еще плюс 40%, примерно так. На данный момент в РФ имеются все необходимые механизмы и мощности для того, чтобы это сделать, несмотря на высокую стоимость таких операций Сейчас мы все равно всем делаем, но просто люди ждут» (Вероника Скворцова, министр здравоохранения РФ, 16 июля 2018 года).
На самом деле. Рассчитать потребности в трансплантации костного мозга пока не представляется реальным: оценки специалистов могут различаться на порядок. По данным NCBI (National Center for Biological Information), в США ежегодно производятся примерно 20 тыс. трансплантаций костного мозга. Если экстраполировать эти данные на Россию, получится, что у нас должны ежегодно производиться примерно 9 тыс. пересадок.
Фантазия №8. Регистр должно создавать государство, а управлять им может только врач
«В Германии, на которую обычно ссылаются как на образец, учредители регистров – это государство в лице федеральной или местной власти, а во главе стоят известные медики. Потому что логистика донорства знакома только им. Регистры доноров должны существовать только совместно с трансплантационными центрами» (Борис Афанасьев, директор НИИ Детской гематологии, онкологии и трансплантологии имени Р.М. Горбачевой, из интервью Русфонду, сентябрь 2018 года).
На самом деле. Крупнейший в Германии Немецкий регистр доноров костного мозга (DKMS) основан в 1991 году Петером Харфом после смерти его жены от лейкемии. Петер Харф – экономист по образованию, параллельно с работой над регистром он руководил косметической компанией Coty. Его дочь Катарина, тоже работавшая в сфере бизнеса, – создательница американского отделения фонда. Сейчас в DKMS больше 8 млн потенциальных доноров. Национальный регистр Германии, объединяющий данные всех донорских центров, создан Красным Крестом земли Баден-Вюртемберг – это общественная организация.
Старейший в Германии Регистр Штефана Морша (названный именем юноши, который болел раком крови, ему сделали трансплантацию, но он умер после операции) создали в 1986 году родители Штефана – Эмиль и Хилтруд. Эмиль до сих пор возглавляет эту организацию, а оперативным управлением в фонде занимается сестра Штефана Сюзанна.
Фантазия №9. Регистры доноров всегда развиваются очень медленно
«В какие сроки вы планируете создать регистр? – Наш единственный план – работать в этом направлении. Но сказать, что это будет через два или три года, мы пока не можем. Зарубежные страны шли к своим регистрам десятки лет. Мы начали эту работу всего пять лет назад» (глава ФМБА Владимир Уйба, из интервью «Известиям» 8 июня 2017 года).
На самом деле. По мировым масштабам наполнение регистров костного мозга пока идет в России чрезвычайно медленно. Например, немецкий DKMS за первый год своего существования сумел привлечь 68 тыс. потенциальных доноров. Сейчас DKMS работает на территории нескольких стран, но в те годы он ограничивался Германией.
Донорство костного мозга не имеет границ: в прошлом году больше 300 трансплантаций было произведено в России с использованием зарубежного донорского материала. Логика всемирного сотрудничества в этой сфере предполагает, что страны не только пользуются международной базой, но и способствуют ее пополнению.
Фото: Justyna Miszkiewicz/Welcomeimages
Что образуется в красном костном мозге
К системе реактивности организма человека принадлежат органы, осуществляющие восприятие всех внешних и внутренних сигналов, их анализ и адекватную конкретной обстановке регуляцию жизнедеятельности, а также интеграцию функций органов и систем организма. Систему реактивности представляют органы иммунной защиты, эндокринные железы, нервная система с ее периферическим сенсорным аппаратом. Эти три части организма объединяются в единую нейро-эндокринно-иммунную систему, поскольку их деятельность взаимно согласована и зависима. Так, нейропептиды, синтезируемые эндокринными нейронами, влияют на активность иммунокомпетентных клеток, а биологические активные вещества иммунокомпетентных клеток оказывают влияние на клетки и ткани, сходные с таковыми для гормонов эндокриноцитов и пептидов нейронов.
Иммунный комплекс органов
Иммунный комплекс органов включает вилочковую железу (тимус), лимфатические узлы, селезенку, лимфоидные образования в стенке пищеварительного тракта и в других органах и красный костный мозг, где развиваются все клетки крови, в том числе осуществляющие иммунный надзор.
Несмотря на топографическую разобщенность, эти органы вместе с кровью и лимфой образуют единую в функциональном отношении систему, обеспечивающую поддержание процессов кроветворения и иммунной защиты. Органы кроветворения представляют собой открытую систему с постоянным перемещением клеток крови.
Различают центральные и периферические органы кроветворения и иммуногенеза. К центральным органам относят красный костный мозг и вилочковую железу. К периферическим кроветворным и иммунным органам принадлежат лимфатические узлы, селезенка, миндалины и другие лимфоидные образования в составе слизистных оболочек органов.
Красный костный мозг
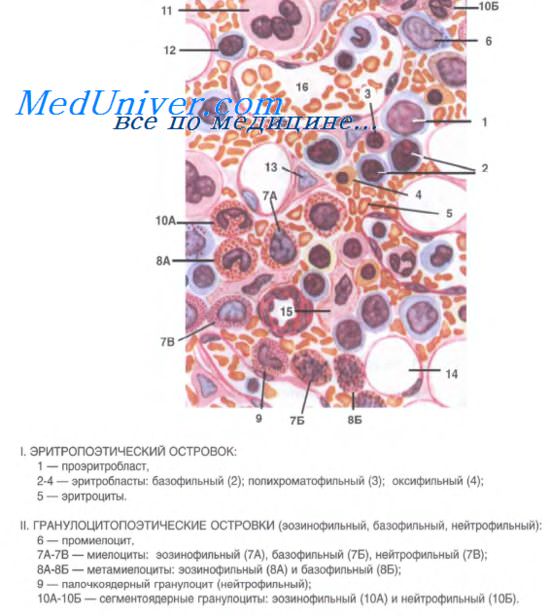
Красный костный мозг — центральный гемопоэтический орган. В нем находится основная часть стволовых кроветворных клеток и происходит развитие клеток миелоидного и лимфоидного рядов, осуществляется антигеннезависимая дифференцировка В-лимфоцитов (рис. 108).
В эмбриогенезе человека костный мозг появляется впервые на 2-3-м месяцах в плоских костях и позвонках, на 4-м месяце — в трубчатых костях конечностей. Различают красный костный мозг и желтый костный мозг. Красный костный мозг находится в эпифизах трубчатых костей, в губчатом веществе плоских костей, в лопатках, грудине, позвонках, костях черепа. Несмотря на такое рассредоточение, функционально он тесно взаимосвязан благодаря постоянной миграции клеток и наличию общих механизмов регуляции процессов кроветворения.
Масса костного мозга 1,6-3,7 кг, что составляет 3-6% от массы тела. Красный костный мозг имеет темно-красный цвет. Консистенция его полужидкая. Это позволяет делать из него тонкие мазки, изучение которых имеет большое диагностическое значение в клинике.
Строма красного костного мозга образована костными перекладинами, идущими от эндоста. Между ними располагается ретикулярная ткань. Последняя состоит из трехмерной сети гетероморфных ретикулярных клеток фибробластического вида (фибробласты костного мозга). Они вырабатывают межклеточное вещество, включающее ретикулярные волокна и амфорный компонент с большим содержанием гликозаминогликанов, ростовые факторы (интерлейкины). Кроме ретикулярных клеток к стромальным клеточным элементам относятся остеобласты, входящие в состав эндоста и способные влиять на пролиферацию гемопоэтических клеток, адвентициальные — малодифференцированные клетки, сопровождающие кровеносные сосуды, жировые клетки. Все эти клетки развиваются в результате дивергентной дифференцировки стромальной стволовой клетки и играют роль микроокружения для развивающихся клеток крови.
Строма красного костного мозга пронизана кровеносными сосудами микроциркуляторного русла. В основном это капилляры синусоидного типа с диаметром около 30 мкм.
В петлях ретикулярной ткани красного костного мозга расположено множество кроветворных клеток (в том числе стволовых кроветворных, клеток-предшественников миело- и лимфопоэза, клеток гранулоцитарного, эритроцитарного, лимфоцитарного, моноцитарного и тромбоцитарного рядов на различных стадиях дифференцировки).
Количество стволовых кроветворных клеток в красном костном мозге наибольшее по сравнению с другими кроветворными органами (50 на 105 клеток). Концентрация стволовых кроветворных клеток вблизи эндоста в 3 раза больше, чем в других участках костного мозга. Именно здесь наиболее интенсивно идет кроветворение, что связывается с выработкой остеобластами интерлейкинов и повышенным содержанием кальция.
Развивающиеся клетки крови располагаются в красном костном мозге группами (островками, «гнездами»), представляющими собой диффероны, или гистогенетические ряды клеточной дифференцировки. Эритробласты находятся вблизи макрофагов, содержащих железо фагоцитированных эритроцитов, и получают от них железо, необходимое для построения гемоглобина. Созревающие гранулоциты образуют островки, подобно эритроидным клеткам, с тем, однако, отличием, что они не имеют связи с макрофагами.
Клетки тромбоцитарного ряда (мегакариобласты и мегакариоциты) локализуются преимущественно вблизи кровеносных синусоидов. Отростки цитоплазмы мегакариоцитов при этом проникают через поры в стенке синусоидов внутрь сосудов, и от них отделяются фрагменты цитоплазмы в виде кровяных пластинок (тромбоцитов). Последние тут же поступают в кровоток.
В красном костном мозге обычно вокруг кровеносных сосудов встречаются небольшие группы лимфоцитов и моноцитов. Среди множества кровяных клеток в красном костном мозге больше всего зрелых клеточных форм или близких к состоянию зрелости (эритробластов, метамиелоцитов и др.). В случае необходимости, например, при кровопотере, они могут быстро завершить дифференцировку и перейти в кровоток. В нормальных условиях через стенку синусоидных капилляров могут проникать лишь зрелые формы клеточных дифферонов.
Желтый костный мозг расположен в диафизах трубчатых костей. Он представлен преимущественно жировой тканью. В жировых клетках содержится пигмент липохром, имеющий желтый цвет. Желтый костный мозг рассматривается как кроветворный резерв, и в случае больших кровопотерь он начинает функционировать как кроветворный орган. Желтый и красный костный мозг — это два функциональных состояния одного кроветворного органа.
Красный костный мозг очень чувствителен к действию радиации, интоксикаций бензолом, толуолом и другими ядами. Особенно уязвимы при этом «бластные» клеточные формы. Происходит опустошение костного мозга и в результате остается лишь ретикулярная строма. Отмечаются выраженные изменения костного мозга, связанные с превращением миелоидной ткани в жировую, а в старческом возрасте — в слизистую, желатинозную ткани.
Регенерация. Костный мозг обладает высокой регенерационной способностью. После удаления части костного мозга или после облучения ионизирующей радиацией происходит его восстановление за счет заселения костного мозга циркулирующими в крови стволовыми клетками. Необходимым условием при этом является сохранение жизнеспособности стро-мальных клеток. В клинике широко применяют различные методы трансплантации костного мозга.
Происхождение стволовых кроветворных клеток в эмбриональном развитии
В организме взрослых млекопитающих кроветворение происходит главным образом в костном мозге. На протяжении всей жизни в нем поддерживаются стволовые кроветворные клетки (СКК), образующие все типы форменных элементов крови. В эмбриональном развитии кроветворение происходит в нескольких анатомических образованиях – желточном мешке, аорто-гонадо-мезонефральной области, плаценте и печени. Однако до сих пор не вполне ясно, где именно в ходе развития эмбриона впервые появляются клетки-предшественники, дающие начало СКК зрелого костного мозга. В обзоре рассмотрены современные представления об особенностях кроветворных клеток, образующихся в желточном мешке, аорто-гонадо-мезонефральной области и плаценте, и их вкладе в заселение печени зародыша, а впоследствии и костного мозга взрослого организма.
Костный мозг – основной орган кроветворения у взрослых млекопитающих, в котором на протяжении всей жизни воспроизводятся стволовые кроветворные клетки (СКК) и образуются зрелые клетки крови. СКК взрослого организма способны давать все типы форменных элементов крови (нейтрофилы, базофилы, эозинофилы, моноциты, лимфоциты, эритроциты, тромбоциты). Кроме того, после деления СКК воспроизводят самих себя, т.е. самоподдерживаются. Благодаря этому они обеспечивают кроветворение неопределенно долгое время. Основным функциональным критерием наличия в ткани СКК является способность к восстановлению кроветворения как после естественной гибели клеток, так и в ходе патологических процессов или действия повреждающих агентов. Полный набор этих свойств появляется у СКК только после рождения, в результате созревания их предшественников, так называемых пре-стволовых кроветворных клеток (пре-СКК), которые возникают в раннем развитии задолго до формирования костного мозга. Хотя процесс образования кроветворной системы изучается более 100 лет, остается не ясным вопрос, где впервые возникают клетки, дающие начало СКК, существующим во взрослом организме.
В печени зародыша собственные предшественники кроветворных клеток не образуются. Кроветворение в ней начинается и поддерживается только за счет миграции клеток, приходящих из желточного мешка, АГМ и плаценты. В печени СКК не только самоподдерживаются и размножаются, но и впервые в эмбриогенезе образуют все типы кроветворных клеток красного и белого рядов. Таким образом, печень является основным кроветворным органом развивающегося плода и обеспечивает его потребность как в стволовых, так и в зрелых клетках крови, что становится особенно важным на тех стадиях развития, когда желточный мешок уже прекращает выполнять кроветворную функцию. В конце внутриутробного периода печень переключается на выполнение специфических функций, свойственных ей во взрослой жизни, а кроветворная активность ней угасает. СКК при этом покидают печень и перемещаются в костный мозг, где к тому моменту уже складываются условия для их существования и самообновления. Попав в костный мозг, СКК прекращают интенсивно делиться и переходят в состояние покоя.
Ведущая роль в смене мест, где в ходе индивидуального развития происходит кроветворение, принадлежит микроокружению. В желточном мешке, АГМ, плаценте и печени оно неодинаково, и это обуславливает различия в поведении кроветворных клеток в этих органах. Так, под влиянием микроокружения плаценты СКК активно размножаются, а микроокружение печени благоприятствует не только их делению, но и дифференцировке. Ключевую роль в формировании микроокружения, или ниши для СКК, играют мезенхимные стромальные клетки (МСК). В ходе развития эмбриона МСК появляются в местах кроветворной активности, по-видимому, подготавливая «ложе» для кроветворных клеток, причем обе системы – мезенхимная и кроветворная – развиваются скоординировано. В индивидуальном развитии МСК претерпевают не только количественные, но и функциональные изменения, что отражает процесс созревания кроветворной ниши. Именно качественные изменения качества кроветворного микроокружения, происходящее параллельно с изменениями СКК, могут иметь определяющее влияние на приобретение последними дефинитивных свойств, присущих клеткам взрослого организма.
Таким образом, эмбриональное кроветворение осуществляется во многих анатомических образованиях, обеспечивающих на протяжении пренатального периода разные этапы формирования и созревания кроветворных клеток. Кроветворные функции этих образований частично перекрываются, но каждое из них имеет и уникальные особенности: желточный мешок служит первым местом продукции функционально активных клеток крови (примитивных эритроцитов), в АГМ закладываются de novo предшественники дефинитивных СКК, плацента обеспечивает размножение СКК, а печень – их поддержание и дифференцировку в множественных направлениях. Существование нескольких мест для кроветворения способствует, с одной стороны, быстрому образованию первых дифференцированных клеток крови, необходимых эмбриону для выживания и роста, а с другой – продукции множества СКК, которые потребуется организму в дальнейшем, уже после рождения. Однажды возникнув, СКК собираются в печени зародыша для размножения и дифференцировки, после чего заселяют костный мозг. На этом пути они попадают в различные ниши и подвергаются различным воздействиям, способствующим их размножению и функциональному созреванию, в результате чего приобретают свойства СКК взрослого организма.
Хотя эмбриональное развитие кроветворной системы изучается уже много лет, многие вопросы, связанные с происхождением клеток крови в эмбриогенезе, до сих пор остаются без ответа. Дальнейшее изучение клеточных и молекулярных механизмов формирования СКК в индивидуальном развитии имеет несомненную значимость не только для понимания фундаментальных аспектов функционирования кроветворной системы, но и для совершенствования методов лечения гематологических заболеваний.