О чем свидетельствует наличие хвоста у зародышей человека об отклонениях в развитии
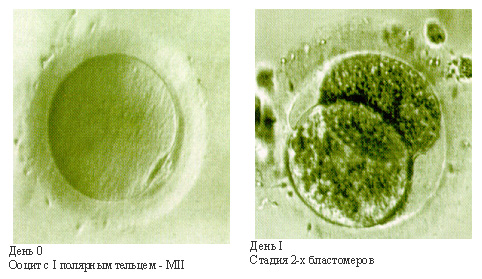
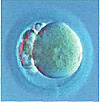
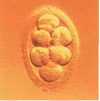
Стадии развития эмбрионов
Однако наличие зигот еще недостаточно для решения вопроса о возможности переноса эмбрионов в полость матки. Сначала необходимо удостовериться в нормальном дроблении и развитии эмбрионов.
Об этом можно судить только исходя из количества и качества делящихся клеток эмбриона и не ранее, чем через сутки после оплодотворения, когда появляются первые признаки дробления.
Наиболее четко они проявляются только на второй день культивирования.
Каждый день эмбриологом проводится оценка эмбрионов с фиксацией всех параметров: количество и качество клеток эмбриона (бластомеров), скорость дробления, наличие отклонений и т.д.
Переносу подлежат только эмбрионы хорошего качества.
До недавнего времени эмбрионы культивировались в течение трех дней и затем переносились в матку и/или замораживались.
В настоящее время широко распространено так называемое продленное культивирование эмбрионов в течение пяти или шести дней, пока они не достигают стадии бластоцисты.
Бластоцисты имеют большую частоту успешной имплантации, позволяя нам переносить меньшее количество эмбрионов и снижать риск многоплодной беременности при увеличении частоты наступления беременности.
Вы можете получить ответ на все возникшие вопросы, воспользовавшись формой обратной связи или лично на консультации у врача репродуктолога.
ФОТО БУДУЩИХ ЭМБРИОНОВ
Начало
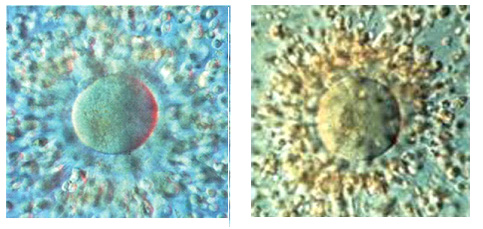
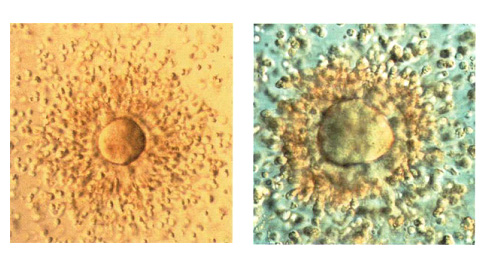
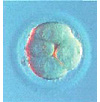
На рисунке справа: Комплекс ооцит-корона-кумулюс через 1 час после получения. Ооцит кажется нормальным. Клетки кумулюса диспергированы, однако клетки короны остаются плотными и полярное тельце не визуализируется, поэтому только удаление короны позволит точно определить степень зрелости ооцита.
На рисунке слева: Комплекс ооцит-корона-кумулюс через час после получения. Нормальный ооцит хорошей формы. Клетки кумулюса хорошо диспергированы. Полярное тельце на 11 часах.
День I (16-20 часов после инсеминации или ИКСИ).
На рисунке слева: Аномальная фертилизация. Через 18 часов после ИКСИ ооцит правильной формы с единственным пронуклеусом и тремя нуклеолями. Перивителлиновое пространство слегка расширено, содержит множество маленьких гранул. 5-6 цитоплазматических фрагментов, включая полярные тельца, видны на 11-12 часах
На рисунке справа: Триплоид
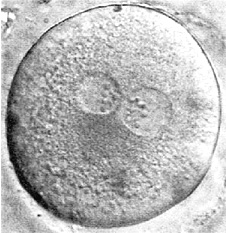
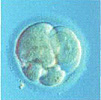
День 2: несостоявшееся первое деление. Единственный бластомер содержит пять маленьках ядер, множественная цитоплазматическая фрагментация. Дальнейшее развитие крайне мало вероятно.
День 2: асимметричное незавершенное первое деление. Дальнейшее развитие крайне мало вероятно.
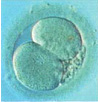
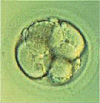
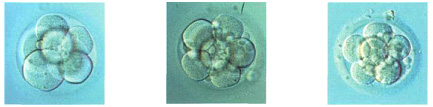
Двухклеточный эмбрион, с легкой асимметрией и фрагментацией.
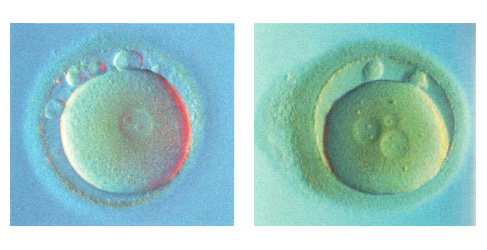
3-клеточный эмбрион с асинхронным делением, и легкой фрагментацией на 5 часах. Три ядра в большом бластомере и ни одного в остальных.
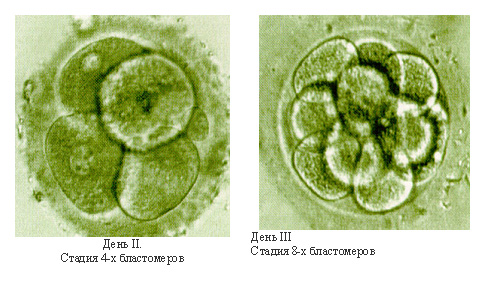
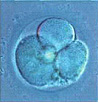
Морфологически ненормальный 4-клеточный эмбрион с выраженной фрагментацией, занимающей около половины объема эмбриона. Жизнеспособность таких эмбрионов резко снижена. Развитие обычно останавливается.
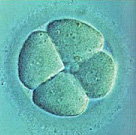
Морфологически нормальный 4-клеточный эмбрион. Все бластомеры одинаковой величины, с ядром и полярным тельцем на 8 часах.
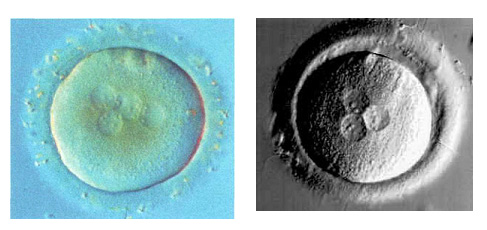
Медленный 5 клеточный эмбрион: 4 одинаковых и один меньший бластомер Такие эмбрионы часто останавливаются в развитии.
Компактизация 4-клеточного эмбриона на день 3. Нередко наблюдается в среде G1.1. Биопсия эмбриона затруднена. Чтобы провести биопсию прибегают к декомпактизации, применяя среды без кальция и магния.
8-клеточный эмбрион неправильной вытянутой формы. Развитие таких эмбрионов сомнительно. Биопсия также затруднена.
День 3. 8-клеточные эмбрионы с несколькими цитоплазматическими фрагментами, которые не нарушают развитие и компактизацию эмбрионов
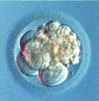
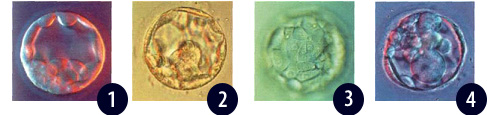
Рисунок 1. День 5. Ранняя бластоциста, 120 часов после инсеминации. Бластоцеле сформировано большими овальными клетками развивающегося трофобласта. Круглые клетки, сконцентри-рованные в нижнем полюсе, образуют внутреннюю клеточную массу.
Рисунок 2. День 5. Ранняя бластоциста, 120 часов после инсеминации. Бластоцеле занимает около половины зародыша. Клетки трофоэктодермы уплощены и растянуты, что аккомодирует экспансию. Клетки внутренней массы различимы внутри полости бластоцисты.
Рисунок 3. День 5, ранняя бластоциста через 120 часов после инсеминации. Клетки полигональны и тесно соединены. Ядра видны в большинстве клеток.
Рисунок 4. День 5, аномальная ранняя бластоциста через 120 часов после инсеминации состоит из небольшого бластоцеле, сформированного меньшим количеством больших плоских клеток. Все еще заметно первителлиновое пространство. Нормальное развитие такой бластоцисты мало вероятно.
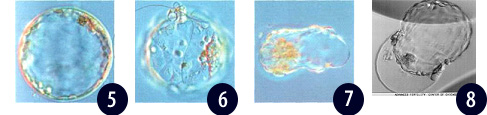
Рисунок 5. День 6, аномальное развитие эмбриона.144 часа после инсеминации трофобласт состоит из большой полости, сформированной монослоем клеток трофоэктодермы. Клетки внутренней массы не идентифицируются Зона пеллюцида очень тонкая.
Рисунок 6. День 6, бластоциста в самом начале процесса хетчинга. Несколько клеток трофоэктодермы видны на 12 часах за пределами зоны пеллюцида, также как внутренняя клеточная масса.
Рисунок 7 и 8. Хэтчинг бластоцисты через 130 часов после инсеминации через V-образное отверстие, сделанное ранее в зоне пеллюцида для биопсии бластомера. Хетчинг эмбрионов при наличии отверстий происходит раньше, чем в интактных эмбрионах.
Полностью вылупившаяся морфологически нормальная бластоциста 130-l40 часов после инсеминации (a) и (b). V-образное отверстие было сделано ранее в зоне пеллюцида для биопсии бластомера. Внутренняя клеточная масса ясно видна в каждой бластоцисте.
Как алкоголь влияет на развитие зародыша и плода?
Токсическое воздействие алкоголя общеизвестно. Рассмотрим его влияние на течение беременности и развитие плода.
По данным отечественного исследователя С. Пащенкова, 318 изученных им случаев течения беременности у женщин, страдающих алкоголизмом, в 240 случаях закончились мертворождением, а 78 детей, появившихся на свет живыми, в 30% случаев страдали грубыми неврологическими расстройствами.
Алкоголь из организма матери через плаценту попадает в организм плода, достигая максимальной концентрации в центральной нервной системе. Получается так, что плод уже внутриутробно принимает немалые дозы алкоголя. Собственно, и сама плацента повреждается этиловым спиртом, что нарушает нормальное снабжение растущего плода кислородом и питательными веществами.
Так как у большинства женщин-алкоголиков печень и почки находятся не в лучшем состоянии, токсические вещества, которые задерживаются в организме беременной, вызывают отравление плода, нарушая процессы его роста и формирования нормальных органов и тканей.
Кровь пьющей беременной женщины обеднена в плане многих важных веществ, в том числе – витаминов, соответственно, плод также их недополучает.
Прямое воздействие алкоголя на растущий плод может вызывать уродства, то есть, как принято считать, этиловый спирт обладает тератогенным действием. Поэтому, употребление спиртного на ранних стадиях беременности, когда идёт закладка всех органов, наиболее опасно. На этих же сроках алкоголь может провоцировать выкидыши.
Но и сама мать непосредственно страдает от воздействия алкоголя: для организма женщины беременность и так является большой нагрузкой, а при алкоголизации заметно снижается иммунитет, повышается риск осложнений со стороны внутренних органов и систем.
У многих возникает вопрос: а есть ли какие-то количества алкоголя, которые можно употреблять при беременности?
Среди населения и даже некоторых врачей бытует точка зрения, что до одного бокала хорошего красного вина в день не только не вредно, но и несёт какую-то пользу. Наша позиция в этом вопросе однозначна: только абсолютная трезвость! Если вам небезразлично благополучие вашего будущего ребенка, полностью исключите спиртное на весь срок беременности!
1. Челюстно-лицевые аномалии
2. Задержка физического и психомоторного развития
3. Врождённые пороки сердца, опорно-двигательного аппарата
4. Нарушения со стороны зрения и слуха
5. Нарушения половой функции.
Далеко не всегда последствия употребления алкоголя беременной видны у родившегося ребёнка сразу. Могут пройти годы, но воздействие алкоголя на плод рано или поздно проявятся, поэтому нужно избавляться от пагубной зависимости сейчас.
Так что, будущие мамы, расставьте правильно приоритеты, осознайте свою ответственность перед будущим человеком, будьте благоразумны!
О чем свидетельствует наличие хвоста у зародышей человека об отклонениях в развитии
Врожденные пороки развития сосудов являются причиной приблизительно 20 % смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетике, детской хирургии и ортопедии, патологической анатомии [1]. Аномалии развития артерий и вен, такие как агенезия, аплазия, артериальные и венозные аневризмы, недоразвитие клапанного аппарата вен возникают при нарушении образования сосудистых стволов. По данным Brewster L., Robinson S., Wang R., Griffiths S., Li H., Peister A., Copland I., McDevitt T. (2017) нарушения ангиогенеза, критичные для жизни, наблюдаются среди населения в 1 % случаев [2], а связанные с заболеванием периферических артерий – в 10 % [3–5]. При этом традиционные варианты реваскуляризации возможны только у 50 % пациентов, остальным потребуются методы клеточной терапии, с использованием клеток костного мозга, мезенхимальных стволовых клеток (мск), обладающих большим потенциалом в качестве альтернативы реваскуляризационной терапии [6]. Nguyen H.L., Boon L.M., Vikkula M. (2017) указывают на то, что возникают сосудистые аномалии как следствие неправильного развития и регуляции ангиогенеза [7]. Исследуя ангиогенез, Varazashvili M.N., Mchedlishvili G.I. (1991), Mchedlishvili G.I. (1996) пришли к выводу, что агрегация эритроцитов вызывает нарушения кровотока и ишемию [8–10].
Знания о патофизиологических основах сосудистых аномалий резко возросли за последние 5 лет, дополнив теорию эмбриогенеза сосудистой системы молекулярно-генетическими находками [11]. Нарушения общих внутриклеточных сигнальных путей, часто активирующие мутации, по мнению автoров новых концепций, вызывают эндотелиальную клеточную дисфункцию [12–14]. Mathiyalagan P., Liang Y., Kim D., Misener S., Thorne T., Kamide C.E., Klyachko E., Losordo D.W., Hajjar R.J., Sahoo S. (2017) большую роль отводят СD34+ стволовым клеткам, которые, по их мнению, способны через паракринную секрецию влиять на ангиогенез. Подавляя и одновременно модулируя экспрессию генов, участвующих в ангиогенезе, ответственных за синтез сосудистого эндотелиального фактора роста, ангиопоэтина 1 и ангиопоэтина 2 (ANG1, ANG2), metallopeptidase 9 (MMP9), thrombospondin 1(TSP1), они оказывают терапевтический эффект при ишемии задних конечностей у мыши, что может быть перспективным для экстраполяции в медицинскую практику [15].
Предметом острых дискуссий является вопрос происхождения эндотелия. Rigato M., Fadini G.P. (2017) считают, что циркулирующие прогениторные клетки (circulating progenitor cells, СРС) и эндотелиальные прогениторные клетки (endothelial progenitor cells, ЕРС) являются незрелыми клетками, участвующими в сосудистой регенерации и связанными со многими аспектами макро-и микрососудистых заболеваний [16]. Lu W., Li X. (2017) считают стволовые/прогениторные клетки (VSCs) выполняющими ключевую роль в развитии организма и важным источником всех видов сосудистых клеток, необходимых для создания, поддержания, регенерации и ремоделирования кровеносных сосудов. Авторы выделяют четыре основных типа VSCs, в том числе эндотелиальные прогениторные клетки (Ерс), гладкие мышечные прогениторные клетки (SMPCs), перициты и мезенхимальные стволовые клетки (Мск) [17]. Lin C.S., Lue T.F. (2013) подвергают сомнению роль перицитов, как стволовых, с учётом экспериментальных доказательств их ингибирующих ангиогенез свойств и функционального разнообразия [18]. Мезенхимальные стволовые клетки (мск) существуют в большинстве тканей взрослого человека и располагаются вблизи или внутри кровеносных сосудов. Ibrahim M., Richardson M.K. (2017) свидетельствуют о важности изучения ангиогенеза, так как состояние этого вопроса тормозит развитие трансплантологии, методов репаративной регенерации во всех областях медицины, и на современном этапе имеет недостаточность в изучении на материале человека [19]. Guerin C.L., Rossi E., Saubamea B., Mignon V., Silvestre J.S., Smadja D.M. (2017), подтвердив результаты Банина В.В., Куприянова В.В., Karaganov J.L., Мчедлишвили, Welt с соавторами [20] выдвинули концепцию реваскуляризации критически ишемизированной конечности за счёт выделенных из костного мозга мелких эмбрионально подобных плюрипотентных эндотелиальных прогениторных клеток, способных дифференцироваться в эндотелиоциты с терапевтическим реваскуляризационным потенциалом [21].
Поскольку ангиодисплазии не относятся к казуистическим находкам, существует острая необходимость разработки стратегий консервативного лечения на основе клеточных технологий. Однако, по данным Kang J.M., Yoon J.K., Oh S.J., Kim B.S., Kim S.H. (2017), в клинической практике использование взрослых стволовых клеток имеет ряд ограничений, таких, как низкая выживаемость клетки и низкая терапевтическая эффективность [22]. Несмотря на значительные успехи в изучении ангиогенеза, наличие нескольких противоречивых концепций развития сосудов в теле эмбриона человека (из мезенхимы и целома), а также участия в ангиогенезе циркулирующих ангиобластов, свидетельствуют о том, насколько далека эта проблема от решения. Множество концепций ангиодисплазий учитывают экзо- и эндогенные, молекулярно-генетические, метаболические и другие факторы, которые на современном этапе не получили окончательного подтверждения, а теория эмбриогенеза сосудистой системы требует значительной доработки, поэтому гистогенез эндотелия на современном этапе является одной из важнейших проблем васкуло- и ангиогенеза [23]. Calderon G.A., Thai P., Hsu C.W, Grigoryan B., Gibson S.M., Dickinson M.E., Miller J.S. (2017) подтвердили исследования Banin V.V. [24]. Jeong H.W., Hernfndez-Rodriguez B., Kim J., Kim K.P., Enriquez-Gasca R., Yoon J., Adams S., Scholer H.R., Vaquerizas J.M., Adams R.H. (2017) указывают, что молекулярные механизмы, регулирующие эндотелиальную активность клеток на различных этапах сосудистого роста, ремоделирования, созревания и покоя, остаются неясными [25]. Васкуло- и ангиогенез представляют собой сложные процессы, которые требуют скоординированных изменений в эндотелиальных клетках [26]. Многочисленные гипотезы происхождения эндотелиоцитов трактуют их развитие в связи с теорией трех зародышевых листков [27]. Существенная роль кровеносных сосудов в тканях и органах человека, понимание функциональных свойств и основополагающей молекулярной основы VSC имеет решающее значение для фундаментальных исследований [28]. Современное неудовлетворительное состояние данных по вопросу эмбрионального ангиогенеза определило направление нашего исследования.
Цель исследования – изучить кровеносные сосуды эмбриона человека в эмбриональном периоде.
Материалы и методы исследования
Исследование выполнено с учётом положений Хельсинской декларации (2000) и с разрешением этического комитета ФГАОУ ВО «Дальневосточный федеральный университет». Биоптаты эмбрионов были получены в соответствии с приказом Минздравмедпрома РФ от 29.04.94 № 82 «О порядке проведения патологоанатомических вскрытий» и в соответствии с номенклатурой клинических лабораторных исследований МЗ РФ (приказ 21 февраля 2000 г. № 64). Изучен материал эмбрионов человека 3, 5, 8 недель эмбрионального развития. Распределение материала представлено в табл. 1.
О чем свидетельствует наличие хвоста у зародышей человека об отклонениях в развитии
Палеонтологические: окаменевшие остатки и отпечатки вымерших древних людей являются прямыми доказательством эволюции.
Тесты
1) Выберите атавизмы
А) волосы на лице, многососковость, способность двигать ушной раковиной
Б) многососковость, мышца двигающая ушную раковину, аппендикс
В) мышца двигающая ушную раковину, третье веко, волосы на лице
Г) мягкий хвост, способность двигать ушной раковиной, третье веко
2. Палеонтологическим доказательством эволюции служит
А) отпечаток раковины моллюска
Б) видовое разнообразие рыб
В) приспособленность рыб к жизни на разных глубинах
Г) наличие раковины у моллюсков
3. Наличие хвоста у зародыша человека на ранней стадии развития свидетельствует о
А) возникших мутациях
Б) проявлении атавизма
В) нарушении развития плода в организме
Г) происхождении человека от животных
4. К эмбриологическим доказательствам эволюции относят
А) ископаемые остатки
Б) рождение людей с увеличенным числом хвостовых позвонков
В) волосяной покров человеческого зародыша
Г) сходство в строении конечностей птиц и млекопитающих
5. Приведите пример палеонтологических доказательств эволюции
А) отпечаток археоптерикса
Б) видовое разнообразие организмов
В) приспособленность рыб к жизни на разных глубинах
Г) наличие раковин у моллюсков
6. К какой группе доказательств эволюции относят строение зародышей позвоночных животных на ранних стадиях развития
А) эмбриологическим
Б) палеонтологическим
В) сравнительно-анатомическим
Г) морфологическим
7) Пример палеонтологических доказательств эволюции позвоночных
А) сходство их зародышей в эмбриональном развитии
Б) филогенетические ряды ископаемых форм
В) наличие рудиментов в системах органов
Г) проявление атавизмов в онтогенезе
8. Находки ископаемых останков предков человека относят к доказательствам эволюции
А) эмбриологическим
Б) биогеографическим
В) палеонтологическим
Г) сравнительно-анатомическим
Практическая работа по биологии на тему»»Признаки сходства зародышей человека и других позвоночных
Практическое занятие № 5
Тема: Выявление и описание признаков сходства зародышей человека и других позвоночных как доказательство их родства.
Цель : Рассмотреть и выявить черты сходства и отличия зародышей позвоночных на разных стадиях развития
Оборудование: Плакаты, таблицы
Краткие теоретические сведения
Эмбриология — наука об индивидуальном развитии организмов .
В 1828 г. Карл фон Бэр сформулировал закономерность, которую называют Законом Бэра:
«Чем более ранние стадии индивидуального развития сравниваются, тем больше сходства удается обнаружить».
II закон – «Биогенетический закон». (Закон Геккеля-Мюллера)
«Каждое живое существо в своем индивидуальном развитии (онтогенез) повторяет в известной степени формы, пройденные его предками или его видом».
1.Прочитайте статью « Данные эмбриологии»
Легко установить родство между организмами при сравнении их эмбриональных стадий развития.
Оказывается. Любой организм в своём индивидуальном развитии повторяет стадии развития предковых форм.
В эмбриогенезе у всех позвоночных закладывается хорда, которая у ланцетника остаётся на всю жизнь, а у всех позвоночных в дальнейшем замещается позвоночником.
В возрасте нескольких недель зародыши человека и других млекопитающих обнаруживают многие черты сходства с рыбами.
По бокам шейного и головного отделов развиваются жаберные борозды. Кровеносная система сходна с характерной для рыб: двухкамерное сердце, хвостовая артерия, кровеносные сосуды в составе шести дуг аорты, подходящие к жаберным дужкам. А также общая форма тела зародыша, хвост, жаберные борозды, нитевидное продолжение заднего отдела спинного мозга.
На следующей стадии наблюдается сходство с земноводными : сюда относятся плавательные перепонки, развивающиеся между пальцами у человеческого зародыша. В нижней части стенки живота человека унаследованы от земноводных сухожильные перетяжки прямых мышц, седалищную артерию (ветвь нижней ягодичной артерии, унаследованную от древних амфибий).
У некоторых взрослых людей можно обнаружить в скелете запястья свободную центральную косточку, характерный признак строения земноводных предков.
В обонятельном отделе человек унаследовал от земноводных часть, называемую якобсоновым органом : он развивается к пятому месяцу утробной жизни в виде канала, идущего из носовой полости в ротовую. Хотя в конце утробного развития этот орган и редуцируется, но его все же можно найти у взрослого человека в виде короткого, слепо оканчивающегося канальца, к которому подходят окончания специальных нервов.
И наконец, остаток мигательной перепонки в виде так называемой полулунной складки, во внутреннем углу глаза. Этой складке соответствует хорошо развитая у современных земноводных, пресмыкающихся и птиц мигательная перепонка. Среди млекопитающих мигательная перепонка подверглась сильной редукции, особенно у китообразных и большинства приматов, но значительно развита, например, у кроликов, кошек и некоторых обезьян.
От пресмыкающихся человек унаследовал ряд признаков, которые обнаруживаются преимущественно в утробный период, например, в развитии головного мозга, в строении и характере причленения конечностей у плода нескольких месяцев.
О родстве человека с низшими млекопитающими свидетельствуют и другие примитивные черты, обнаруживающиеся в его онтогении. Например, у человеческого шестинедельного зародыша формируются зачатки нескольких пар молочных желез вдоль млечных линий. По всему телу (кроме ладоней и подошв) развивается довольно густой, хотя и мелкий волосяной пушок (лануго). В ротовой полости на мягком нёбе образуются валики, характерные для обезьян, хищных и других млекопитающих.
В возрасте 1,5-3 месяцев заметно выражен хвостовой отдел, в котором можно обнаружить и конечный отдел зачаточного позвоночного столба с 8-9 закладками позвонков. К концу этого срока наружный отдел хвоста редуцируется. Во внутреннем участке хвостового отдела сохраняется 4 (от 6 до 2) позвонка, сросшись, образуют копчик.
Сходство с зародышами антропоидов сохраняется наибольшее время. В процессе развития зародыша общие признаки, присущие типам и классам животных, проявляются раньше, чем особенности рода и вида. Эта закономерность является общей в развитии зародышей позвоночных животных и получила название биогенетического закона. Сходство на ранних стадиях развития зародыша человека и животных объясняется тем, что человек прошел сложный путь исторического развития, продолжавшийся миллионы лет. Этот путь в основных чертах отражается в развитии человеческого зародыша.
Таким образом, в процессе индивидуального развития каждый вид повторяет своё историческое развитие.
2.Запишите этапы развития человека.
Развитие начинается с оплодотворения.
Возникшая зигота дробится.
Образуются стадии: морула, бластула, гаструла.